Pharmazeutische SDS
GMP („Good Manufacturing Practice“) steht für die Gute Herstellungspraxis für Arzneimittel.
GMP stellt sicher, Arzneimittel in ausschließlich Kompromisslos hoher Qualität in Verkehr gebracht werden. Diese Qualitätsansprüche müssen während der Herstellung, Verarbeitung, Verpackung und Lagerung von Arzneimitteln erfüllt werden. Betriebe müssen weltweit die GMP-Vorschriften befolgen, um eine Herstellungserlaubnis zu bekommen. Als Voraussetzung für die Projektierung von Computersystemen im GMP‑Umfeld müssen genehmigte Spezifikationen vorliegen. Zentraler Bestandteil der Good Engineering Practice (GEP) ist die Anwendung einer anerkannten Projektmethodik basierend auf einem definierten Lebenszyklus.
Das Ziel liegt in der Bereitstellung einer den Anforderungen angemessenen Lösung, dem sogenannten risikobasierten Ansatz. Der „Good Automated Manufacturing Practice Supplier Guide for Validation of Automated Systems in Pharmaceutical Manufacture“ (kurz: GAMP), ist ein Leitfaden, der sich zum Standardregelwerk für die Validierung computergestützter Systeme in der pharmazeutischen Industrie entwickelt hat. Die folgende Abbildung zeigt den allgemeinen Ansatz gemäß GAMP 5 zur Entwicklung
computergestützter Systeme. Es beginnt mit der Planungsphase eines Projektes und endet mit der Aufnahme der pharmazeutischen Produktion nach Abschluss der Tests und der Berichterstattung.
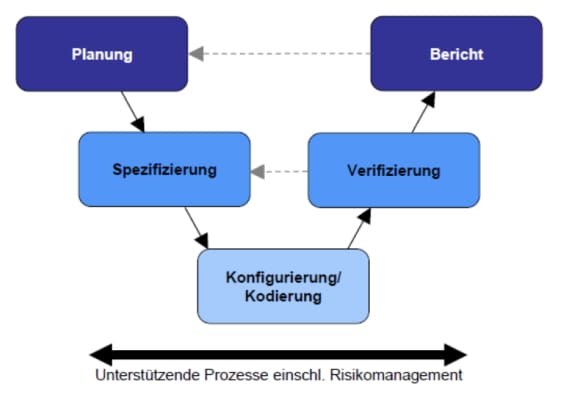
Quelle: Gamp 5 – Ein risikobasierter Ansatz für konforme GxP-computergetützte Syteme.
